L’importanza
dell’Ossido nitrico. Una molecola strategica per i sistemi antiossidanti
dell’organismo
Dr. Prof. Eugenio Luigi Iorio, MD, PhD Docente Scuola Specializzazione
Biochimica Clinica – Seconda Università di Napoli (Napoli). Presidente
Comitato Scientifico Osservatorio Internazionale Stress Ossidativo (Parma)
L’ossido
di azoto (NO), impropriamente chiamato ossido nitrico, è una specie chimica
reattiva di natura radicalica centrata sull’azoto. Considerato per decenni un
gas altamente inquinante – responsabile, tra l’altro, del cosiddetto “buco
dell’ozono” – solo in epoca molto recente esso è stato individuato come uno
dei più potenti mediatori biochimici che gli organismi viventi producono al
loro interno al fine di controllare molte delle loro funzioni (1).
È
sicuramente degno di nota il fatto che a questa sostanza sia legato il premio
Nobel 1998 per la Medicina/Fisiologia, attribuito, appunto, al ricercatore
americano Louis Ignarro “per le sue scoperte riguardanti l’ossido nitrico come
molecola segnale nel sistema cardiovascolare” (2). Sei anni prima, la
prestigiosa rivista scientifica “Science” aveva eletto l’NO come “molecola
dell’anno” (3).
L’NO è
una sostanza abbastanza ubiquitaria prodotta a partire dall’amminoacido
L-arginina in una reazione multi-step catalizzata dall’enzima ossido nitrico
sintetasi (figura 1). Quest’ultimo esiste in numerose isoforme, alcune
costitutive (cellule endoteliali, piastrine,
sistema nervoso) ed altre inducibili (macrofagi,
leucociti polimorfonucleati, cellule endoteliali, cellule muscolari lisce,
epatociti), e ciò dà ragione
dell’ampia distribuzione dei siti di produzione dell’importante mediatore nel
nostro organismo (4).
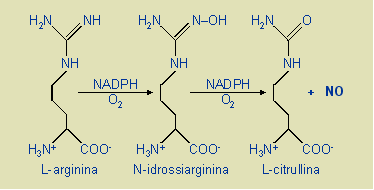 |
Figura 1.
Sintesi schematica dell’ossido nitrico a partire dalla L-arginina
Nei
sistemi biologici, l’NO agisce come un importante messaggero intra- ed
inter-cellulare regolando numerosissime funzioni, in primis quella
dell’endotelio vascolare (1). Infatti, in seguito ad adeguata stimolazione
(meccanica o chimica), le cellule endoteliali producono l’NO che, in parte,
diffonde nel compartimento ematico, riducendo l’aggregabilità delle piastrine
e l’adesività dei leucociti alle pareti dei vasi sanguigni, e, in parte,
raggiunge la sottostante muscolatura liscia vascolare inducendone il
rilasciamento. I conseguenti effetti anti-aggreganti, anti-infiammatori ed
anti-ipertensivi sono ritenuti di grande importanza nella prevenzione dell’aterosclerosi
(1). D’altronde, i famosi nitriti esteri e la stessa nitroglicerina
sublinguale (Carvasin®), ampiamente usati come anti-anginosi
decenni prima della “scoperta” dell’NO, sono, in realtà, dei “donatori” di
questo mediatore ed è relativamente recente la messa a punto delle
nitro-aspirine, derivati “nitrati” dell’acido acetilsalicilico in grado di
rilasciare NO a livello periferico (1, 5). Rimanendo nell’ambito della
farmacologia cardiovascolare, giova anche sottolineare che il sildenafil (Viagra®)
agisce “prolungando” la durata d’azione dell’NO a livello dei corpi cavernosi
del pene, contribuendo in questo modo a migliorare la funzione erettile,
variamente compromessa nell’impotenza maschile (1).
Oltre all’effetto
primario sull’endotelio, all’NO è riconosciuto un ruolo determinante di
mediatore biochimico in numerose funzioni, a livello cerebrale (es. controllo
dell’apprendimento e della memoria), gastrointestinale (modulazione delle
secrezioni e della motilità), respiratorio (modulazione del tono della
muscolatura liscia bronchiale), renale (autoregolazione del flusso ematico), e
così via (6, 7). All’NO, in quanto radicale, è attribuita un’importante
funzione di difesa nei confronti delle infezioni batteriche e, probabilmente,
nel controllo della crescita dei tumori (7). A questo proposito occorre
aggiungere, comunque, che condizioni di aumentato stress ossidativo – es.
eccessiva produzione di anione superossido – comportano la conversione dell’NO
in perossinitrito, una forma radicalica alla quale è legata la tossicità del
mediatore primario (8).
Dopo
che ha agito, l’NO viene trasformato in una serie di derivati, quali i nitriti
ed i nitrati, che si accumulano, in funzione della quantità del mediatore
primario prodotto, nel sangue ed in altri fluidi extracellulari per poi essere
definitivamente allontanati dall’organismo attraverso le urine. Infatti,
numerosi studi sperimentali e clinici hanno documentato che i livelli
plasmatici ed urinari di nitriti/nitrati correlano abbastanza bene con la
produzione “endogena” di NO, anche dopo particolari terapie (9).
Poiché la ridotta biodisponibilità dell’NO (figura 2) è ritenuta responsabile
dell’insorgenza e/o dell’aggravamento di numerose quanto diffuse e temibili
malattie, quali l’ipertensione arteriosa e l’aterosclerosi (2, 6-9), numerosi
studi hanno valutato la possibilità di aumentare la sintesi endogena del
mediatore centrato sull’azoto attraverso l’integrazione alimentare.
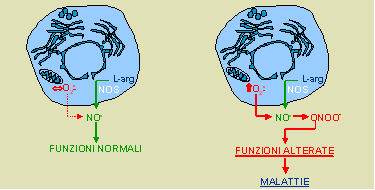 |
(NOS, ossido nitrico sintetasi,
ONOO-, perossinitrito)
La
strada più battuta, in tal senso, è stata la somministrazione di dosi generose
di L-arginina per via orale. Infatti, come si è detto in precedenza, questo
amminoacido semi-essenziale (10) è il diretto precursore dell’NO (2).
In
tale contesto, studi condotti su animali da laboratorio hanno dimostrato che
l’integrazione alimentare con L-arginina, favorendo la sintesi di NO, accelera
la guarigione di ulcere in ratti diabetici Sprague-Dawley (11), migliora la
disfunzione endoteliale in hamster resi sperimentalmente
iperlipemici-iperglicemici (12) ed esercita un effetto benefico
sull’ipertensione ed il metabolismo lipidico in ratti diabetici (13). Questi
favorevoli effetti, confermati recentissimamente anche in ratti resi diabetici
mediante streptozotocina (14), dimostrano che è sperimentalmente possibile,
attraverso l’aggiunta di L-arginina alla dieta, migliorare la sintesi endogena
di NO e revertire gli effetti sfavorevoli dovuti ad una ridotta
biodisponibilità del mediatore. D’altra parte, sembra che la carenza di
arginina eserciti di per sé effetti deleteri sullo sviluppo del sistema
linfoide in animali da esperimento (15).
Studi
condotti sull’uomo hanno confermato ed esteso le potenziali indicazioni
“terapeutiche” della L-arginina che, sia come tale – grazie all’attività
immuno- ed endocrino-modulatrice – sia, soprattutto, come precursore dell’NO,
si sta rivelando particolarmente utile nel trattamento di numerosissime
patologie, dalle varie forme cliniche della cardiopatia ischemica, quale
l’angina pectoris, alla claudicatio intermittens, dall’ipertensione arteriosa
all’insufficienza cardiaca congestizia, dalla preeclampsia alla disfunzione
erettile (16-19). Inoltre, gli effetti dell’integrazione alimentare con
L-arginina sono stati valutati anche nella terapia dell’AIDS, del diabete,
della sindrome X, di alcune malattie gastrointestinali, dell’infertilità
maschile e femminile, della cistite interstiziale e della demenza senile, con
risultati molto interessanti (16, 20). Infine, esperimenti condotti su topi
indicano che la L-arginina migliora le prestazioni muscolari in regime di
esercizio aerobico attraverso un aumento della produzione di NO, e ciò
conferma il già noto ruolo di questo amminoacido sulle performance atletiche
(21).
Nel
complesso, quindi, i dati sperimentali e quelli clinici qui analizzati,
dimostrano univocamente che l’aggiunta di moderate quantità di L-arginina alla
dieta abituale può migliorare alcune condizioni fisio-patologiche attraverso
un aumento della sintesi endogena dell’NO, importantissimo mediatore
biologico, di cui l’amminoacido è il diretto precursore.
Oggi
sono disponibili numerose formulazioni orali a base di L-arginina, tra le
quali andrebbero preferite quelle arricchite con antiossidanti, quali il
selenio. Infatti, in talune circostanze, quali quelle legate allo stress
ossidativo (squilibrio fra produzione ed inattivazione di specie reattive
dell’ossigeno, quali l’anione superossido) l’NO, pur prodotto in quantità
adeguate, viene rapidamente convertito in sottoprodotti biologicamente
inattivi o addirittura tossici (es. perossinitrito) (vedi figura 2).
Pertanto, sebbene la L-arginina possa esercitare di per sé un’azione
anti-radicalica (22), la presenza di un antiossidante nella sua formulazione,
è potenzialmente in grado di aumentare in maniera più efficiente la
“biodisponibilità” dell’NO, sia fornendo il precursore fisiologico (L-arginina)
sia neutralizzando le specie chimiche reattive che tenderebbero ad inattivarlo
(selenio).
Le
“dosi” di L-arginina da assumere variano a seconda delle indicazioni (23).
Ovviamente, come per qualsiasi sostanza introdotta nel nostro organismo, vale
la precauzione di ordine generale di consultare il medico prima dell’uso e di
non abusare di queste formulazioni in termini di dosi e/o durata del
trattamento. In particolare, sebbene alla usuali dosi, la L-arginina è ben
tollerata – in quanto amminoacido normalmente presente nelle proteine – essa
non dovrebbe essere assunta da soggetti in trattamento con altri farmaci che
potenziano l’azione dell’NO, aumentando il rischio di tossicità da
superdosaggio (23).
Bibliografia
1.
Brennan PA, Moncada S.
From pollutant gas to biological messenger: the diverse actions of nitric
oxide in cancer. Ann R Coll Surg Engl. 2002. 84(2): 75-78.
2.
Ignarro LJ. Nitric
oxide: a unique endogenous signalling molecule in vascular biology. The
Nobel Prize 1998 Medicine/Physiology Lecture. 1988.
3.
Snyder SH. Nitric
oxide: first in a new class of neurotransmitters? Science. 1992.
257: 494-496.
4.
Förstermann U,
Boissel J-P, Kleinert H. Expressional control of the ‘constitutive’
isoforms of nitric oxide synthase (NOS I and NOS III). FASEB J. 1998.
12: 773–790.
5.
Ignarro LJ, Napoli
C, Loscalzo J. Nitric oxide donors and cardiovascular agents modulating the
bioactivity of nitric oxide. An Overview. 2002. Circ Res. 90:
21-28.
6.
Ignarro LJ. Biological effects of nitric oxide. Proceedings of the “1st
International meeting on nitric oxide. From basic science to clinical
evidence”.
7.
Ignarro LJ. Plenary lecture. Proceedings of the “1st
International meeting on nitric oxide. From basic science to clinical
evidence”.
8.
Channon KM, Qian HS,
George SE. Nitric oxide synthase in atherosclerosis and vascular injury.
Insights from experimental gene therapy. Arterioscler Thromb Vasc Biol.
2000. 20: 1873–1881.
9.
Fujiwara N, Osanai T,
Kamada T, Katoh T, Takahashi K, Okumura K. Study on the relationship
between plasma nitrite and nitrate level and salt sensitivity in human
hypertension modulation of nitric oxide synthesis by salt intake.
Circulation. 2000. 101: 856-861.
10.
Lehninger AL, Nelson DL, Coc MM. Principi di Biochimica. 1994.
2: 563. Zanichelli, Bologna. II Ed.
11.
12.
Popov D, Costache G,
Georgescu A, Enache M. Beneficial effects of L-arginine supplementation in
experimental hyperlipemia-hyperglycemia in the hamster. Cell Tissue Res.
2002. 308 (1): 109-120.
13.
Kawano T, Nomura M,
Nisikado A, Nakaya Y, Ito S. Supplementation of L-arginine improves
hypertension and lipid metabolism but not insulin resistance in diabetic rats.
Life Sci. 2003. 73 (23): 3017-3026.
14.
Kohli R, Meininger
CJ, Haynes TE, Yan W, Self JT, Wu G. Dietary L-arginine supplementation
enhances endothelial nitric oxide synthesis in streptozotocin-induced diabetic
rats. J Nutr. 2004. 134(3): 600-608.
15.
de Jonge WJ, Kwikkers
KL, te Velde AA, van Deventer SJ, Nolte MA, Mebius RE, Ruijter JM, Lamers MC,
Lamers WH. Arginine deficiency affects early B cell maturation and lymphoid
organ development in transgenic mice. J Clin Invest. 2002. 110
(10): 1539-1548.
16.
17.
Wu G, Meininger CJ.
Arginine nutrition and
cardiovascular function.
J Nutr. 2000. 130: 2626–2629.
18.
Palloshi A, Fragasso
G, Piatti P, Monti LD, Setola E, Valsecchi G, Galluccio E, Chierchia SL,
Margonato A. Effect of oral L-arginine on blood pressure and symptoms and
endothelial function in patients with systemic hypertension, positive exercise
tests, and normal coronary arteries. Am J Cardiol. 2004. 3 (7):
933-935.
19.
Stanislavov R,
Nikolova V. Treatment of erectile dysfunction with pycnogenol and L-arginine.
J Sex Marital Ther. 2003. 29 (3): 207-213.
20.
Battaglia C.
Adjuvant L-arginine treatment for in-vitro fertilization in poor responder
patients. Hum Reprod. 1999. 14 (7): 1690-1697.
21.
Maxwell AJ, Ho H-KV, Le CQ, Lin PS, Bernstein S, Cooke JP. L-arginine
enhances aerobic exercise capacity in association with augmented nitric oxide
production. J Appl Physiol. 2001. 90: 933–938.
22.
Jablecka A, Checinski
P, Krauss H, Micker M, Ast J. The influence of two different doses of L-arginine
oral supplementation on nitric oxide (NO) concentration and total antioxidant
status (TAS) in atherosclerotic patients. Med Sci Monit. 2004. 10
(1): CR29-CR32.
23.
Fried R, Merrell WC.
The arginine solution. 1999. Warner Books.